Abbott получила одобрение FDA на стентированный тканевый клапан Epic Max
Компания Abbott (NYSE:ABT) объявила сегодня, что FDA одобрило стентированный тканевый клапан Epic Max для лечения аортальной регургитации или стеноза.
Последнее дополнение к платформе хирургических клапанов Epic компании Abbott имеет оптимизированную конструкцию для дальнейшего улучшения кровотока. В 2021 году FDA одобрило следующее поколение стентированных тканевых клапанов Epic Plus и Epic Plus Supra.
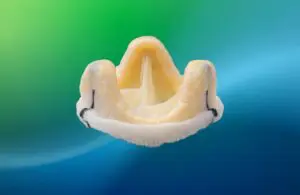
Epic Max, биопротезный клапан, предлагает вариант замены клапана для пациентов, которым не подходят препараты для разжижения крови. Компания Abbott разработала его для достижения «превосходной гемодинамики», говорится в пресс-релизе компании. Низкопрофильная рама устройства также облегчает потенциальные будущие транскатетерные вмешательства для пациентов.
Доктор Джозеф Э. Бавария, сердечно-сосудистый хирург из Университета Пенсильвании, сказал, что Epic Max «оптимизирует кровоток». Он добавил, что низкий профиль облегчает возможные будущие кардиологические вмешательства.
Компания Abbott заявила, что создала новейший клапан Epic на основе своей давней платформы, используя долгосрочные характеристики и долговечность. Компания разработала клапан, чтобы сохранить и облегчить будущие варианты лечения заболеваний сердечных клапанов на протяжении всей жизни. Он предназначен для лечения людей с негерметичным или суженным аортальным клапаном.
«С помощью Epic Max мы решаем две важные задачи: Прежде всего, мы улучшаем гемодинамику сердечного клапана, что и является целью процедуры. Во-вторых, мы сохраняем возможность выбора и управления заболеванием на протяжении всей жизни пациента, что становится все более важным моментом при выборе метода лечения», — говорит Майкл Дейл, вице-президент подразделения структурного сердца компании Abbott.