Noah Medical сообщает о положительных данных по хирургическому роботу
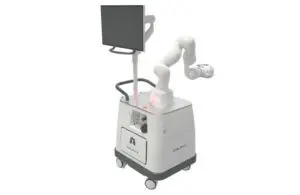
Компания Noah Medical сегодня объявила о положительных результатах исследования точности своей хирургической роботизированной платформы Galaxy System.
Компания Noah Medical, расположенная в Сан-Карлосе, Калифорния, разработала Galaxy и ее аксессуары для обеспечения бронхоскопической визуализации и доступа. Эти возможности позволяют проводить диагностические и терапевтические процедуры в дыхательных путях пациента.
Система оснащена передовыми технологиями визуализации, которые обеспечивают обновление местоположения потенциально раковых образований в режиме реального времени. В пресс-релизе компании Noah говорится, что технология разработана с целью повышения эффективности инструмента в лезионе и диагностической эффективности.
Galaxy получила разрешение FDA в марте этого года. На прошлой неделе компания Noah Medical привлекла 150 миллионов долларов для поддержки своей платформы хирургического робота.
В исследовании MATCH проверялась точность «инструмент в илеоне» системы Galaxy. Компания Noah Medical опубликовала результаты исследования в журнале Journal of Bronchology & Interventional Pulmonology.
О результатах исследования Noah Medical MATCH
Согласно пресс-релизу, исследование продемонстрировало, что технология TiLT системы Galaxy обеспечивает 100% успешную навигацию к очагу поражения. Она также продемонстрировала 100% диагностическую эффективность и 95% точность попадания инструмента в очаг поражения. Технология TiLT включает в себя интегрированный томосинтез и расширенную рентгеноскопию.
«Система Galaxy System была разработана в сотрудничестве с врачами и для врачей», — сказал Цзянь Чжан, основатель и генеральный директор компании Noah Medical. Эти результаты помогают подтвердить передовой дизайн и технологию нашей системы». Эта важная публикация появилась после недавнего одобрения системы Galaxy Управлением по контролю за продуктами и лекарствами США и первого испытания на человеке, которое сейчас проходит в Австралии. Система Galaxy находится на быстром пути к коммерциализации в рамках нашей миссии по улучшению качества жизни пациентов во всем мире».
Цель MATCH заключалась в оценке точности инструмента при определении периферических узелков в легких, подтвержденных с помощью компьютерной томографии на свиной модели. По словам Ноа, полученные результаты дают критически важное представление, поскольку существующие роботизированные платформы по-прежнему подвержены расхождению КТ с телом. Компания заявила, что подтверждение высокой частоты попадания инструмента в легион может позволить Galaxy увеличить частоту постановки окончательного диагноза.
Главный исследователь доктор Криш Бхадра назвал Galaxy «новой категорией робототехники, управляемой изображениями». Бхадра из CHI Memorial Hospital в Чаттануге, штат Теннесси, сказал, что исследование «делает нас на один шаг ближе» к цели решения проблемы расхождения КТ с телом в интервенционной пульмонологии.